Con el fin de desarrollar fármacos más eficaces contra una variedad de cánceres, los investigadores han estado analizando la estructura molecular de muchas enzimas ligadas a enfermedades en el cuerpo humano. Un caso intrigante es Taspase 1, un tipo de enzima conocida como proteasa. La función principal de las proteasas es descomponer las proteínas en fragmentos de péptidos más pequeños o en aminoácidos individuales.
Taspase 1 parece desempeñar un papel vital en una variedad de procesos fisiológicos, incluido el metabolismo celular, la proliferación, la migración y la terminación. Sin embargo, el funcionamiento normal de Taspase 1 puede fallar, dando lugar a una variedad de enfermedades, que incluyen leucemia, cáncer de colon y de mama, así como glioblastoma, una neoplasia maligna particularmente letal e incurable en el cerebro.
Debido a que la desregulación de Taspase 1 está cada vez más implicada en la génesis y metástasis de varios cánceres, se ha convertido en un candidato atractivo para el desarrollo de fármacos. Pero antes de que esto pueda suceder, los investigadores necesitarán un plano muy detallado de la estructura de esta proteasa.
Esta estructura será muy beneficiosa para avanzar en el diseño de inhibidores de Taspase1 para la terapia contra el cáncer
En un nuevo estudio que aparece en la revista Structure de Cell Press, investigadores de la Universidad Estatal de Arizona describen sus estudios, que revelan la estructura de Taspase 1 como nunca antes se había visto.
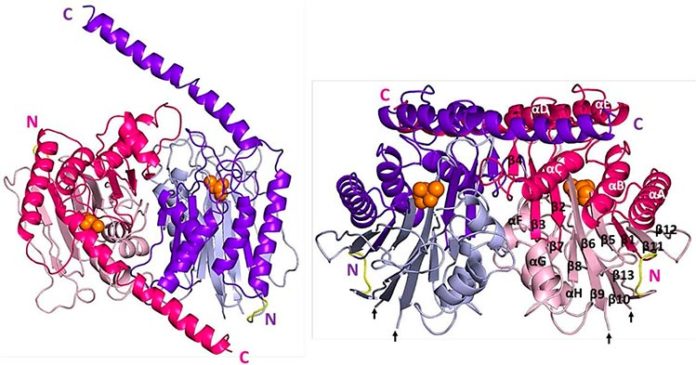
El estudio revela, por primera vez, la estructura tridimensional catalíticamente activa de Taspase 1, que muestra una región previamente inexplorada que es esencial para el funcionamiento de la molécula. La estructura se resolvió mediante cristalografía de rayos X y se confirmó con microscopía electrónica.
Petra Fromme, directora del Biodesign Center for Applied Structural Discovery, destaca la gran importancia del trabajo: «Estoy muy emocionada de que hayamos podido resolver la primera estructura de la enzima activa funcional, ya que tendrá enormes implicaciones para el desarrollo basado en esta estructura de nuevos fármacos contra el cáncer«.
Los resultados del estudio muestran que la reducción de esta región helicoidal crítica de Taspase 1 limita la actividad de la proteasa, mientras que la eliminación de la región helicoidal desactiva el funcionamiento de Taspase 1 por completo. Investigaciones anteriores sugerían que la desactivación de la actividad de Taspase 1 para bloquear la progresión del cáncer podría lograrse sin efectos secundarios dañinos.
«Hemos informado de la importancia de un fragmento largo previamente no observado de la proteína en la actividad catalítica de Taspase1, que puede usarse como un objetivo atractivo para inhibir Taspase1«, comenta José Martín-García, científico principal del proyecto y coautor correspondiente junto con la profesora Fromme. «La estructura cristalina de la Taspase1 activa descrita en nuestro artículo será muy beneficiosa para avanzar en el diseño de inhibidores de Taspase1 para la terapia contra el cáncer«.
Fuente: bioRxiv.






















