Un equipo internacional de investigadores ha descubierto que las células de Schwann, que abundan en el sistema nervioso periférico y crean una capa protectora alrededor de las fibras nerviosas, desempeñan un papel esencial en el dolor de la migraña. Su estudio, realizado en ratones y células de Schwann humanas y publicado en Nature Communications, ilustra cómo se señala el dolor desde el interior de las células de Schwann y encuentra varias formas de bloquear esta señalización, proporcionando objetivos potenciales para nuevos tratamientos para la migraña.
Las migrañas afectan a más del 15% de los adultos, y las mujeres tienen el doble de probabilidades que los hombres de experimentar estos intensos dolores de cabeza. Se sabe que el péptido relacionado con el gen de la calcitonina (CGRP), una pequeña proteína del sistema nervioso, desempeña un papel importante en el dolor de la migraña; de hecho, una nueva clase de medicamentos para prevenir las migrañas usa inyecciones de anticuerpos monoclonales para atacar al CGRP o su receptor.
Los investigadores tienen dos ideas para tratar el dolor de migraña: evitar que el receptor CGRP ingrese a los endosomas en primer lugar, o usar nanopartículas para enviar medicamentos
«Si bien el CGRP se ha relacionado con el dolor de migraña, la forma en que causa el dolor ha sido un área de controversia en la comunidad científica«, comenta el doctor en Medicina Nigel Bunnett, profesor y presidente del Departamento de Patobiología Molecular de la Facultad de Odontología de la NYU. Bunnett dirigió el estudio con el médico Pierangelo Geppetti, profesor de farmacología clínica en la Universidad de Florencia y director del Centro de Dolor de Cabeza del Hospital Universitario Careggi.
«El éxito de los anticuerpos monoclonales CGRP para la migraña y la escasa capacidad de los anticuerpos para penetrar la barrera hematoencefálica sugieren que el CGRP provoca dolor en la periferia en lugar de dentro del cerebro«, añade Bunnett, investigador del Centro de Investigación del Dolor de la NYU.
Para explorar el mecanismo celular del dolor provocado por CGRP, Bunnett y sus compañeros de estudio se centraron en las células de Schwann, que se encuentran fuera del cerebro en el sistema nervioso periférico. Los investigadores estudiaron ratones en los que el receptor CGRP, llamado CLR/RAMP1, estaba desactivado en las células de Schwann. Modificaron el receptor CGRP eliminando RAMP1, uno de los dos componentes importantes del receptor, de las células de Schwann en el área facial de los ratones.
Células de Schwann humanas
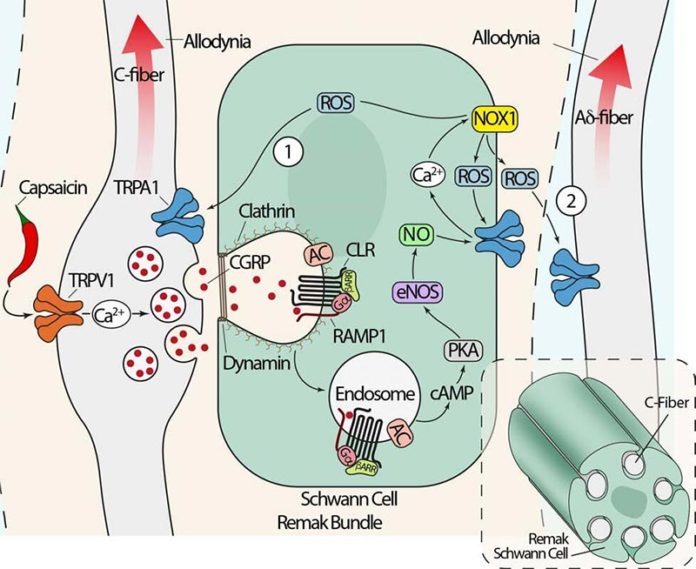
En ratones normales, la administración de CGRP hizo que la región facial fuera muy sensible, un indicador del dolor de migraña. Sin embargo, en ratones que carecían del receptor CGRP en las células de Schwann, el CGRP no provocó dolor. En un segundo experimento, los investigadores administraron capsaicina, una sustancia química que se encuentra en el chile picante. La capsaicina activa un canal de iones llamado TRPV1, que libera CGRP y generalmente causa dolor. Una vez más, la capsaicina no causó dolor similar a la migraña en ratones que carecían del receptor CGRP en las células de Schwann, lo que brinda más apoyo a la idea de que el receptor CGRP en las células de Schwann desempeña un papel fundamental en el dolor de la migraña.
Usando células de Schwann humanas, los investigadores descubrieron lo que ocurre dentro de estas células para señalar el dolor. Descubrieron que cuando CGRP se une a su receptor en una célula de Schwann, el receptor se mueve hacia un compartimento dentro de la célula llamado endosoma. Dentro de los endosomas, el receptor CGRP continúa emitiendo señales durante períodos prolongados de tiempo. Esa señalización genera óxido nítrico, un mediador del dolor, que luego se libera de la célula de Schwann e interactúa con un canal iónico llamado TRPA1 en una neurona adyacente. TRPA1 excita la neurona y transmite señales de dolor.
Endosomas
Esta nueva comprensión de cómo se origina el dolor dentro de las células de Schwann le dio a los investigadores dos ideas para tratar el dolor de migraña: evitar que el receptor CGRP ingrese a los endosomas en primer lugar, o usar nanopartículas para enviar medicamentos dirigidos al receptor CGRP en los endosomas.
Para mantener los receptores CGRP fuera de los endosomas, los investigadores inhibieron la clatrina y la dinamina, dos proteínas que son importantes para que las sustancias entren en las células. La inhibición de la clatrina y la dinamina redujo la señalización del dolor, lo que ofrece un objetivo prometedor para nuevos tratamientos de la migraña.
Los investigadores también bloquearon con éxito el dolor provocado por CGRP utilizando nanopartículas, en las que encapsularon un fármaco de molécula pequeña que se une y bloquea el receptor CGRP. Si bien la mayoría de los medicamentos sólo alcanza la superficie de las células, las nanopartículas pueden diseñarse para ayudar a que los medicamentos alcancen el endosoma dentro de una célula y liberar el medicamento una vez que llegue al lugar previsto. En las células de Schwann, las nanopartículas transportaron el fármaco a los endosomas y bloquearon el receptor CGRP, lo que inhibió de forma poderosa el dolor de la migraña.
Desarrollo de tratamientos
«Si bien el papel de CGRP en el dolor de migraña es bien conocido, nuestro estudio es el primero en conectar directamente las células de Schwann con el dolor de migraña. Ofrece nuevos enfoques potenciales para el tratamiento de este dolor, basados en nuestra mejor comprensión de cómo se señala desde dentro de los endosomas«, asegura Bunnet.
Los investigadores están trabajando con varios socios, incluido el Centro Nacional para el Avance de las Ciencias Traslacionales de los Institutos Nacionales de Salud, para continuar estudiando el uso y la seguridad de la administración de fármacos con nanopartículas antes de que estos tratamientos puedan probarse en humanos.
Fuente: Nature Communications.