El estrés oxidativo, caracterizado por niveles elevados de moléculas inestables llamadas especies reactivas de oxígeno, está asociado con la neurodegeneración y la enfermedad cardiovascular. Sin embargo, hasta hace poco no ha sido posible demostrar una relación causal entre el estrés oxidativo y los estados patológicos. Un nuevo estudio utilizó quimiogenética para activar una proteína de levadura recombinante expresada en tejidos de ratón para manipular los niveles de estrés oxidativo en ratones vivos. Investigadores del Hospital Brigham and Women’s, la Escuela de Medicina de Harvard y los Institutos Novartis para la Investigación Biomédica aplicaron enfoques quimiogenéticos en un nuevo modelo de ratón transgénico para introducir estrés oxidativo en los vasos sanguíneos y las neuronas.
«Nuestros hallazgos pueden ayudarnos a comprender la remodelación cardíaca que se observa en los corazones de los pacientes con enfermedades neurodegenerativas«
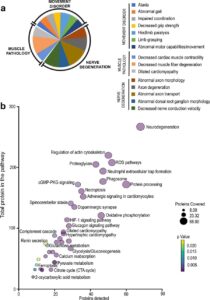
Inicialmente, los investigadores se propusieron utilizar este nuevo modelo de ratón transgénico para identificar vías a través de las cuales el estrés oxidativo podría causar disfunción de los vasos sanguíneos y provocar enfermedades como hipertensión y aneurismas aórticos. Pero se sorprendieron al descubrir que estos ratones desarrollaron rápidamente una ataxia profunda, caracterizada por la incapacidad para caminar.
Investigando más, encontraron que conjuntos específicos de neuronas sensoriales en las células nerviosas periféricas habían sufrido una degeneración por el estrés oxidativo causado por el transgén. Y cuando los investigadores observaron los corazones de estos animales, encontraron que el músculo cardíaco había desarrollado hipertrofia cardíaca.
La ataxia de Friedreich
Esta combinación de degeneración de neuronas sensoriales e hipertrofia cardíaca está asociada con la ataxia de Friedreich (AF), una enfermedad neurodegenerativa progresiva que es la forma más común de ataxia hereditaria que se encuentra en los pacientes. Los investigadores también caracterizaron tipos específicos de células inflamatorias involucradas en estas respuestas, ofreciendo una comprensión más completa de los mecanismos a través de los cuales la ataxia de Friedreich causa hipertrofia cardíaca.
«Nuestro equipo siguió un fenotipo inesperado que descubrimos en una nueva línea de ratones transgénicos y encontró nuevas y sorprendentes conexiones entre los nervios periféricos y el corazón«, indica el doctor en medicina Thomas M. Michel, de la División Brigham de Medicina Cardiovascular. «Nuestros hallazgos pueden ayudarnos a comprender la remodelación cardíaca que se observa en los corazones de los pacientes con enfermedades neurodegenerativas«.
El estudio se publica en la revista Nature Communications.