Investigadores del MIT han hallado una vía para aumentar drásticamente la sensibilidad de la espectroscopía de resonancia magnética nuclear, una técnica utilizada para estudiar la estructura y composición de muchas clases de moléculas, incluidas las proteínas relacionadas al Alzheimer y otras enfermedades.
Utilizando este nuevo método, los científicos deberían ser capaces de analizar en minutos estructuras que antes les hubiera llevado años descifrar, afirma Robert Griffin, profesor de química Arthur Amos Noyes. Esta nueva aproximación, que utiliza pulsos cortos de potencia de microondas, permitiría a los investigadores determinar la estructura de muchas proteínas complejas que han sido difíciles de estudiar hasta ahora.
«Esta técnica debería abrir extensas áreas en ciencias químicas, biológicas, relacionadas con los materiales y en medicina, que antes eran inaccesibles”, confirma Griffin, autor senior de este estudio.
El estudiante postdoctoral del MIT Kong Ooi Tan es el principal autor del artículo, que apareció ayer en la revista Sciences Advances. Los exestudiantes postdoctorales del MIT Chen Yang y Guinevere Mathies, junto a Ralph Weber de Bruker BioSpin Corporation, están también entre la nómina de autores del artículo.
La espectroscopía de resonancia magnética nuclear tradicional utiliza las propiedades magnéticas del núcleo atómico para revelar las estructuras de las moléculas que contienen esos núcleos. Utilizando un campo magnético fuerte que interactúe con los espines nucleares del hidrógeno y de otros átomos marcados isotópicamente, como el carbono o el nitrógeno, esta espectroscopía mide un rasgo conocido como cambio químico para esos núcleos. Estos cambios son únicos para cada átomo, y sirven como huellas dactilares para reconocerlos, lo que lleva a revelar cómo están conectados.
La sensibilidad de la espectroscopía depende de la polarización de los átomos —una medida de la diferencia entre la población de espines nucleares “up” (arriba) y “down” (abajo) en cada conjunto de espines-. Cuanto mayor es la polarización, mayor la sensibilidad que puede ser alcanzada. De forma habitual, los investigadores tratan de incrementar la polarización de sus muestras mediante la aplicación de un campo magnético más fuerte, por encima de los 35 teslas.
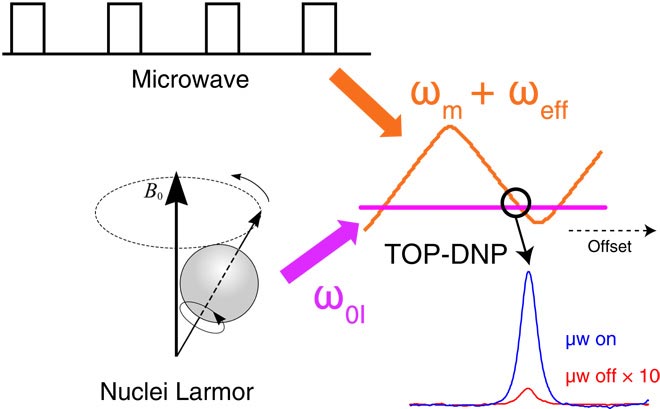
 Otro enfoque, que han estado desarrollando durante los últimos 25 años Griffin y Richard Temkin, del Plasma Science and Fusion Center del MIT, aumenta la polarización utilizando una técnica llamada “polarización dinámica nuclear” (DNP, en inglés). Esta técnica involucra una transferencia de polarización desde los electrones no pareados de los radicales libres del núcleo del hidrógeno, carbono, nitrógeno o fósforo, en la muestra que está siendo estudiada. Esto aumenta la polarización y facilita descubrir las características estructurales de la molécula.
Otro enfoque, que han estado desarrollando durante los últimos 25 años Griffin y Richard Temkin, del Plasma Science and Fusion Center del MIT, aumenta la polarización utilizando una técnica llamada “polarización dinámica nuclear” (DNP, en inglés). Esta técnica involucra una transferencia de polarización desde los electrones no pareados de los radicales libres del núcleo del hidrógeno, carbono, nitrógeno o fósforo, en la muestra que está siendo estudiada. Esto aumenta la polarización y facilita descubrir las características estructurales de la molécula.
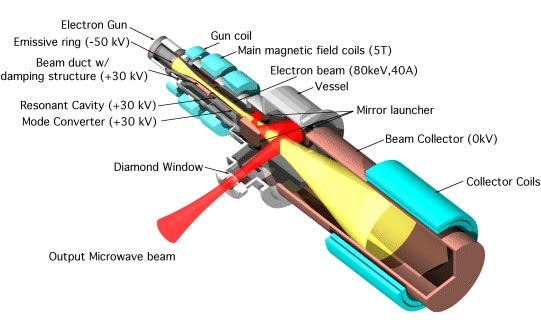
La DNP se realiza normalmente irradiando continuamente la muestra con microondas de alta frecuencia, utilizando un instrumento llamado girotrón. Esto aumenta la sensibilidad de la espectroscopía aproximadamente 100 veces. Sin embargo, este método requiere una gran cantidad de energía y no funciona bien en campos magnéticos de más intensidad que podrían ofrecer mejoras de resolución aún más importantes.
Para superar este problema, el equipo del MIT ideó una forma de administrar pulsos cortos de radiación de microondas, en lugar de someter a la muestra a una exposición continua de microondas. Al liberar estos pulsos a una frecuencia específica, fueron capaces de aumentar la polarización más de 200 veces mayor. La cifra es similar a la de la DNP tradicional, pero requiere únicamente un 7% de su energía, y puede ser implementada en campos magnéticos de más intensidad.
«Podemos transferir la polarización de forma muy eficiente utilizando radiación microondas en pulsos”, confirma Tan. “Con la radiación microondas continua, simplemente disparas la radiación microondas, y no tienes control sobre las fases o la longitud del pulso”.
Con este aumento de la sensibilidad, muestras que se tardaría 110 años en analizar podrían ser estudiadas en sólo un día, según comentan los investigadores. En el artículo de Sciences Advances, demostraron la técnica usándola para analizar moléculas de prueba estándar, como una mezcla de glicerol-agua, pero ahora planean utilizarla en moléculas más complejas.
Un área importante de interés es la proteína beta amiloide, que se acumula en los cerebros de los pacientes de Alzheimer. Los investigadores también planean estudiar una variedad de proteínas unidas a la membrana, como los canales iónicos y las rodopsinas, que son proteínas sensibles a la luz que se encuentran en las membranas bacterianas y en la retina humana. Debido a que su sensibilidad es tan grande, este método puede proporcionar datos útiles de un tamaño de muestra mucho más pequeño, lo que podría facilitar el estudio de proteínas que son difíciles de obtener en grandes cantidades.
Este estudio fue publicado ayer en Science Advances.